|
【分子】
いくつかの非金属の原子が結合してできた安定な粒子を〔 分子 〕という。原子は分子になることにより安定な状態になる。つくられた分子は,1つの粒子としてふるまう。
例)H2OやCO2
H2O分子はH原子2つとO原子1つが結合してできた粒子,CO2分子はC原子1つとO原子2つが結合してできた粒子。H2OやCO2はそれぞれ安定な1つの粒子としてふるまう。
|
 |
|
原子(多くは単独では不安定な粒子)は,先に学習した〔 イオン 〕になること,これから学習する〔 分子 〕になることで安定化する。
|
 |
|
|
|
分子を表す化学式
イオンからなる物質は,多数の陰イオンと陽イオンが一定の割合でイオン結合により集まっているので,構成粒子の比で表した〔
組成式 〕で表した。分子は決まった数の原子が結合して1つの粒子となっているので構成粒子の数で表した〔 分子式 〕で表す。
例)NaCl(組成式) 多数のNa+とCl-が1:1でイオン結合により集まっている。
H2O(分子式) H原子2つとO原子1つが結合して1つの粒子になっている。
【共有結合】
2つの原子の間で,それぞれの原子が〔 価電子 〕(最外殻の電子)を出し合って,互いに〔 共有 〕することによってできる結合を〔 共有結合 〕という。最外殻の電子を共有することによって互いに安定な電子配置になる。
例)H原子とO原子の共有結合(H2O分子の生成)
H原子とO原子の電子式(最外殻の電子だけを元素記号の周りに「・」で示した化学式)
|
|
分子を表す化学式
イオンからなる物質を表す化学式は〔 組成式 〕といった。これに対して分子を表す化学式を〔 分子式 〕という。組成式は構成粒子を比で表したのに対して分子式は構成粒子の数を示している。
例)組成式 NaCl ⇒ 多数のNa+とCl-が1:1の割合でイオン結合している。
分子式 H2O ⇒ H原子2つとO原子1つが結合している。
【共有結合】
2つの原子の間で,それぞれの原子が〔 価電子 〕(最外殻の電子)を出し合って,互いに〔 共有 〕することによってできる結合を〔 共有結合 〕という。最外殻の電子を共有することによって互いに安定な電子配置になる。
例)H原子とO原子の共有結合(H2O分子の生成)
H原子とO原子の電子式(最外殻の電子だけを元素記号の周りに「・」で示した化学式)
|
 |
|
H原子2つとO原子1つで互いに価電子を足りない分共有すると,
|
 |
|
【電子式と構造式】
電子対
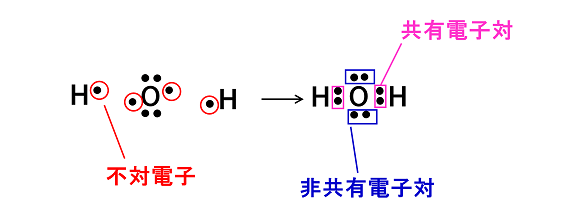
電子式を書くときに元素記号の周りに電子を「・」で示すが,電子は2つで対になる。対になった電子を電子対という。電子対の中で,共有結合をつくっている電子対を 〔 共有電子対 〕,共有結合に使われていない電子対を〔 非共有電子対 〕という。また対になっていない電子を〔 不対電子 〕という。
例)H2O
|
 |
|
一般的に,共有結合では互いの〔 不対電子 〕を出し合って共有し結合する。
練習問題
次の原子の電子式を書け。
(1) C (2) N (3) F (4) S (5) Cl
|
 |
|
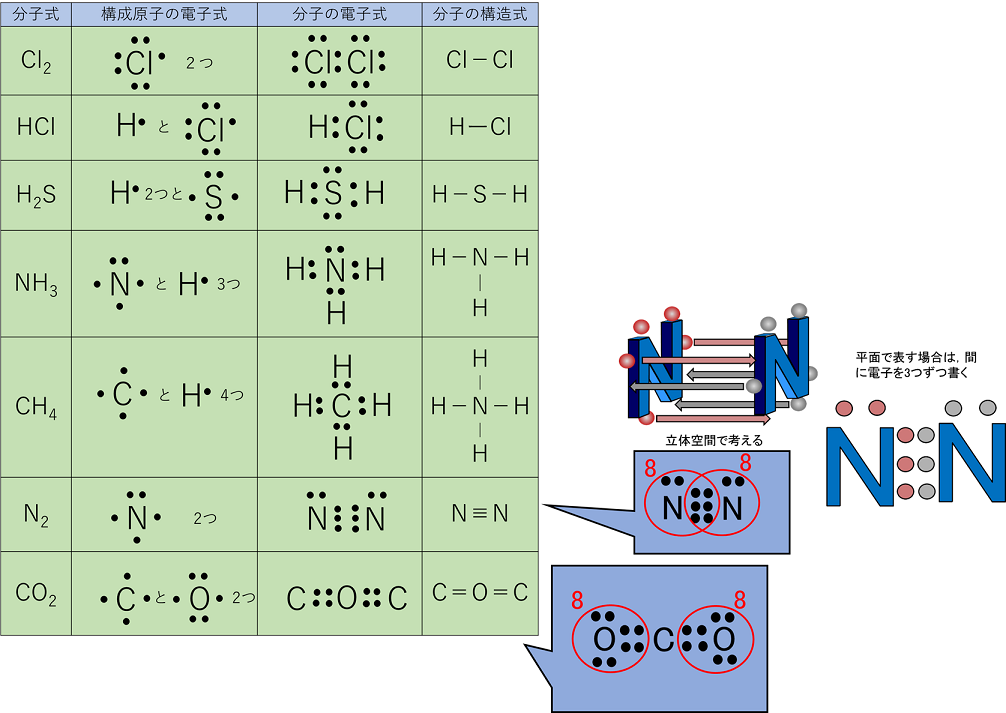
主な分子の電子式と構造式
(3つ以上の原子からなる分子の電子式は不対電子が多い原子を中心に,少ない原子を周りに並べ共有電子対をつくる。)
|
 |
|
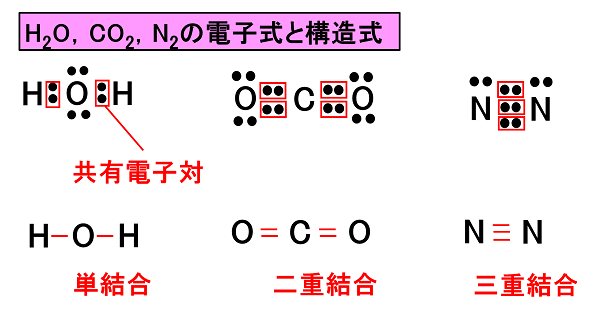
構造式
分子をつくる原子間の1対の共有電子対を「-」で示した化学式を構造式という。また,「-」を価標という。
例)H2O,CO2,N2
|
 |
|
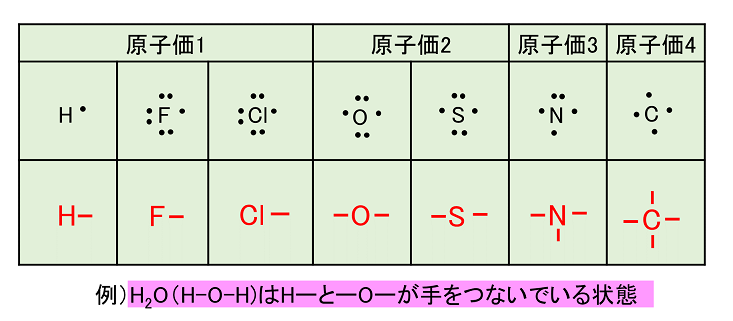
原子価
1つの原子から出ている価標は不対電子の数と等しい。この数をその原子の〔 原子価 〕という。原子価はそれぞれの原子の「手の数」と考えるとよい。
|
 |
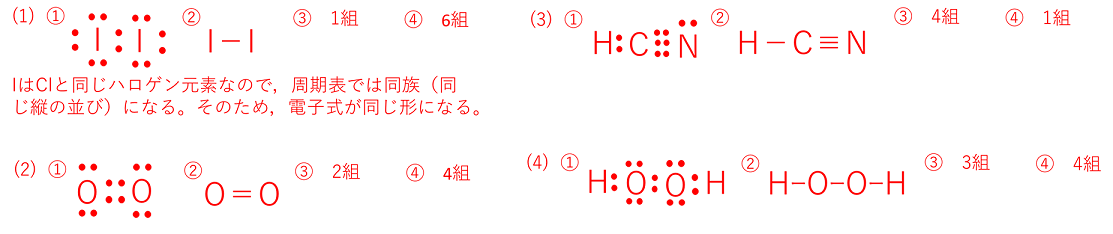
| 例題 次の物質の①電子式,②構造式をそれぞれ記せ。また,③共有電子対 ④非共有電子対が何組あるかをそれぞれ記せ。
(1) ヨウ素I2 (2) 酸素O2 (3) シアン化水素HCN (4) 過酸化水素H2O2
|
 |
 |
|
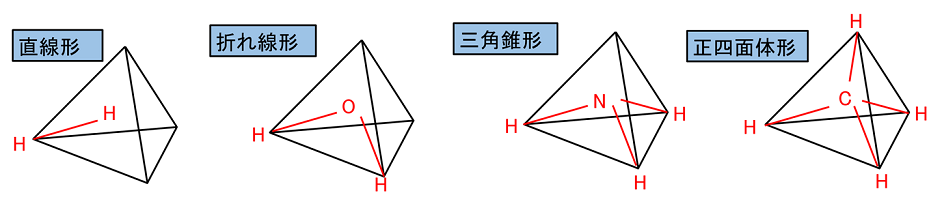
【分子の立体構造】
構造式は平面で示しているので,分子の立体的な形を表していない。原子価(原子の手の数)は多くて4なので,原子は正四面体の中心から頂点に向かって手をのばしていると考えられる。その手に他の原子が結合するので,単結合のみからなる分子には次のような立体構造が存在する。
|
 |
|
二重結合や三重結合を含む分子は,結合の部分が直線型や平面になる。
|
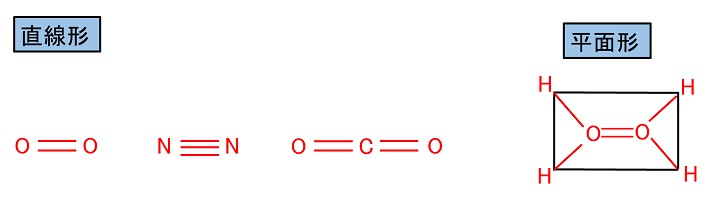 |
|
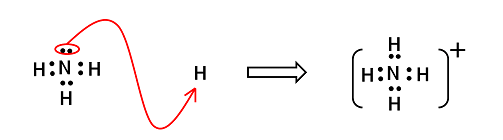
【配位結合】
通常の共有結合は,2つの原子が互いに不対電子を出し,共有してできる結合である。これに対し,2つの原子間で,一方の原子がもつ非共有電子対を共有することによってできる共有結合を〔 配位結合 〕という。
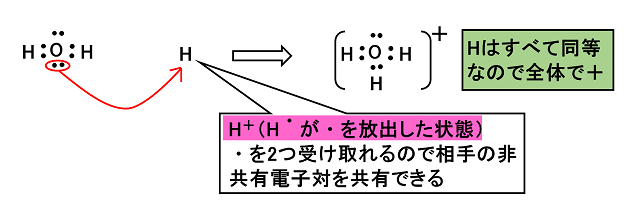
例1)オキソニウムイオンH3O+とアンモニウムイオンNH4+
|
オキソニウムイオンH3O+
H2Oの非共有電子対にH+が共有結合した形 |
アンモニウムイオンNH4+
NH3の非共有電子対にH+が共有結合した形 |
 |
 |
|
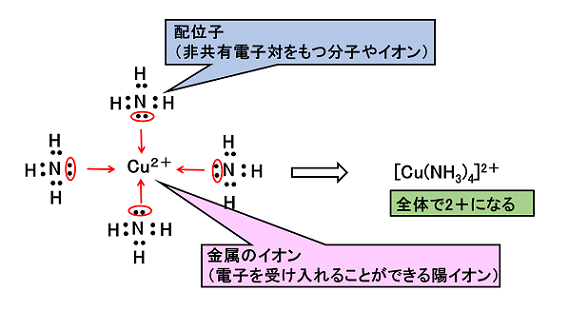
例2)錯イオン
NH3などの非共有電子対をもつ分子は,金属のイオンに配位結合することができる。金属のイオンは陽イオン(原子が電子を放出してできたイオン)なので,NH3などが持つ非共有電子対を共有することができる。このときできるイオンを〔 錯イオン 〕といい,NH3などの分子を〔 配位子 〕という |
 |
|
〈参考〉
配位子には,分子や陰イオンがあり,つぎのようなものがある。
H2O(アクア),NH3(アンミン),OH-(ヒドロキシド),CN-(シアニド),Cl-(クロリド)
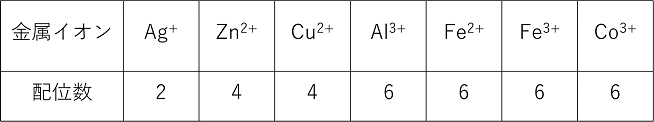
配位数:金属イオンに配位する配位子の数を配位数といい,金属イオンの種類にのよりほぼ決まっている。
|
 |
|
錯イオンの電荷数:金属イオンと配位子の電荷の和になる。
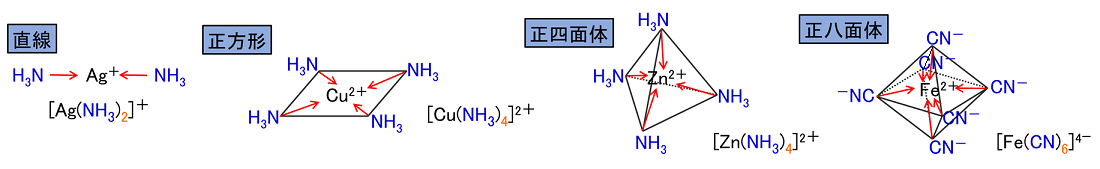
錯イオンの形:錯イオンの形は,その配位数によって次のような形をとる。
直線型(2配位),正方形(4配位),正四面体(4配位),正八面体(6配位)
|
 |
錯イオンの名称
(配位数),(配位子名),(金属名),(金属イオンの価数)の順で呼び,最後に全体が陽イオンのときは「イオン」,全体が陰イオンのときは「酸イオン」をつける。配位数はモノ(1),ジ(2),トリ(3),テトラ(4),ペンタ(5),ヘキサ(6)・・・で示す。 |
 |
|
例題 次のイオンのうち,配位結合が含まれるものを選べ。
① NaOH ② NH4Cl ③ H2SO4 ④ K4[Fe(CN)6]
②,④ |
| |
 |